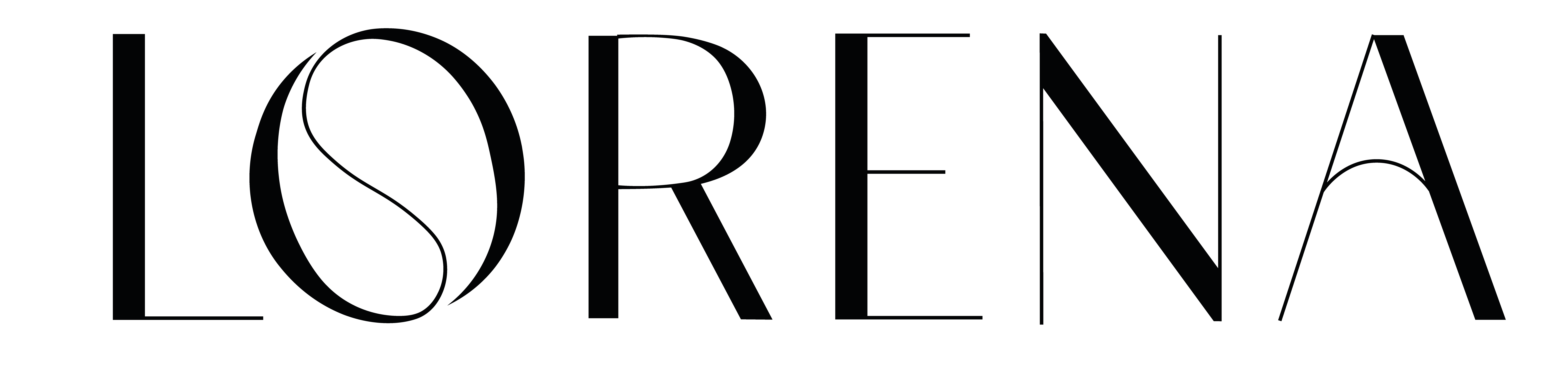Paxlovid, antiviral da Pfizer, recebe aprovação da Anvisa
Até o ano passado, o medicamento era liberado no país e prescrito para pacientes com maior risco de desenvolver a forma grave do coronavírus

Desenvolvido pela farmacêutica Pfizer, o antiviral Paxlovid foi registrado pela Agência Nacional de Vigilância Sanitária (Anvisa) de forma definitiva no último dia 29 de dezembro. Embora seja utilizado no Brasil desde 2022, inicialmente estava disponível apenas em farmácias particulares, ao custo de R$ 4,5 mil (uma cartela com 30 comprimidos), porém agora é distribuído no Sistema Único de Saúde (SUS).
Nota da diretora médica da Pfizer Brasil
Adriana Ribeiro, diretora médica da farmacêutica Pfizer Brasil, afirmou em nota sobre a aprovação do registro: “Esse é mais um avanço importante no tratamento da doença, especialmente para pacientes com problemas cardíacos, renais, diabetes, idosos, tabagistas, com obesidade ou que tratam câncer, ou outras condições que afetam a imunidade”. De acordo com ela, uma em cinco pessoas no mundo possui um fator de risco responsável por aumentar as chances de desenvolver a forma grave do coronavírus. Com isso, o registro definitivo do Paxlovid reafirma a qualidade, segurança e eficácia do medicamento.
Estudos realizados pela Pfizer para desenvolver a pílula antiviral apontaram que os riscos de agravamento do estado de saúde e o óbito podem reduzir em até 89% em pacientes com comorbidades.
Princípios ativos do Paxlovid
O medicamento Paxlovid pertence à classe dos inibidores de protease, o qual exerce sua ação, inibindo uma enzima (protease) que o SARS-CoV-2 utiliza para se replicar.

Pílula antiviral Paxlovid (Foto: reprodução/AP Photo/Stephanie Nano)
No dia 14 de dezembro de 2021, a Pfizer divulgou os resultados do estudo de Fase 2/3 (EPIC-HR) desse antiviral para uso oral em pacientes de alto risco para COVID-19, assim como os resultados da análise interina do estudo de Fase 2/3 para pacientes de risco padrão para COVID-19 (EPIC-SR). Considerando os resultados do primeiro estudo, a agência regulatória dos Estados Unidos da América (U.S. Food and Drug Administration) autorizou, em 22 de dezembro de 2021, o uso emergencial desse antiviral em pacientes adultos e pediátricos (a partir de 12 anos ou com mais de 40kg) de alto risco para COVID-19.
O uso do medicamento
Paxlovid contém as substâncias ativas nirmatrelvir e ritonavir. O nirmatrelvir é ativo contra o vírus que causa a COVID-19. O ritonavir prolonga o efeito terapêutico do nirmatrelvir. A dose recomendada é de 2 comprimidos de nirmatrelvir com 1 comprimido de ritonavir por via oral duas vezes ao dia (de manhã e à noite).
Foto destaque: Remédio antiviral Paxlovid da farmacêutica Pfizer (Reprodução/Pfizer/Site Poder 360).