Covid-19: EUA inicia vacinação de crianças menores de cinco anos
FDA, órgão de fiscalização sanitária responsável, autoriza vacinas em duas doses em crianças menores de cinco anos nos Estados Unidos e amplia campanha de vacinação contra Covid-19.
Na última semana, o órgão de fiscalização sanitária dos Estados Unidos, o “Food and Drug Administration” (FDA), semelhante à Anvisa, aumentou os casos de indicação do uso emergencial do imunizante da Moderna, que passou a incluir uma nova faixa etária infantil, a de crianças de 6 meses a 17 anos. A aplicação da vacina da Pfizer também sofreu alterações no público-alvo indicado, contemplando agora, também as crianças de 6 meses a 4 anos de idade.
Mais recentemente, no sábado, dia (18), o CDC – Centro de Controle e Prevenção de Doenças, dos Estados Unidos, também aprovou outras novas vacinas a serem aplicadas em crianças menores de cinco anos, facilitando a aplicação de imunizantes nessa faixa etária.
Os EUA possuem um público de cerca de 17 milhões de crianças que se enquadram na idade estabelecida e tornaram-se aptas a receberem as vacinas.
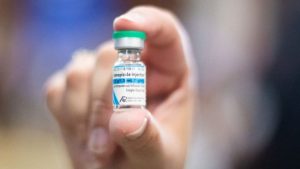
Pessoa sendo vacinada contra covid-19 (Foto: Reprodução/ NSC Total)
O FDA também anunciou uma série de especificações para a administração de vacinas, as duas doses que serão aplicadas em crianças de 6 meses a 5 anos deverão conter 255 microgramas cada, sendo aplicadas em um intervalo de quatro semanas entre elas.
No entanto, apesar de o FDA já ter autorizado o uso da vacina da Moderna em crianças de 6 a 17 anos de idade, o CDC ainda não anunciou a recomendação para essas idades, dessa forma, a vacinação ainda não está autorizada para essa faixa etária.
De acordo com a declaração do Comitê Consultivo de Vacinas e Produtos Biológicos Relacionados, que integra o FDA, as duas vacinas apresentam benefícios que superam os risco que elas podem apresentar, e ressalta que ambas apresentaram resultados positivos nos ensaios clínicos realizados, por isso, o órgão recomendou a liberação da aplicação de imunizantes para essa faixa etária, a aprovação facilitaria o acesso a vacinas para crianças e ampliaria as campanhas de vacinação dos EUA.
Foto Destaque: Vacinas contra covid-19. Reprodução/ GOV.